Udtrykket leukæmi refererer til forskellige kræftformer i det bloddannende system (“blodkræft”). Alle har det til fælles, at degenererede hvide blodlegemer (leukocytter) formerer sig ukontrolleret. Navnet antyder dette: “Leukæmi” betyder “hvidt blod”. Læs mere om symptomer, årsager, behandling og prognose for leukæmi her!
Leukæmi: kort oversigt
- Hvad er leukæmi? Gruppe af kræftformer i det hæmatopoietiske system. Også kaldet “blodkræft” eller “leukose”.
- Almindelige former: Akut myeloid leukæmi (AML), akut lymfoblastisk leukæmi (ALL), kronisk myeloid leukæmi (CML), kronisk lymfocytisk leukæmi (CLL, faktisk en form for lymfom)
- Mulige symptomer: Træthed og træthed, nedsat ydeevne, hurtig træthed, hudblæning, tendens til blødning og blå mærker (hæmatom), tendens til infektioner, feber af uklar oprindelse, vægttab, nedsved osv.
- frekvens: Hvert år får 13.700 mennesker i Tyskland leukæmi, normalt mellem 60 og 70 år. Mænd er lidt mere berørt end kvinder. Cirka fire procent af patienterne er børn under 15 år.
- Behandlingsmuligheder: afhængigt af typen og stadiet af leukæmi; fx Kemoterapi, tyrosinkinaseinhibitorer, interferoner, monoklonale antistoffer, strålebehandling, stamcelletransplantation osv.
- prognose: Akut leukæmi kan ofte hærdes, hvis den opdages og behandles i god tid. Ved kronisk leukæmi kan terapi forlænge overlevelsen for mange patienter. Healing er højst mulig her ved en højrisiko-stamcelletransplantation.
Leukæmi: symptomer
Leukæmi kan pludselig manifestere sig med symptomer og køre hurtigt. Læger taler derefter om akut leukæmi, I andre tilfælde udvikles blodkræft langsomt og langsomt. Så er det et spørgsmål kronisk leukæmi.
Akut leukæmi: symptomer
Symptomerne på akut leukæmi udvikler sig relativt hurtigt. Symptomer på både akut lymfoblastisk leukæmi (ALL) og akut myelooid leukæmi (AML) inkluderer:
- reduceret effektivitet
- vedvarende feber
- natlig svedtendens
- træthed
- vægttab
- Knogesmerter i led og led (især hos børn med ALLE)
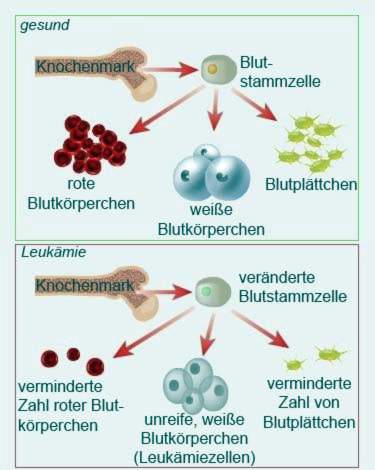
Patientens krop producerer store mængder umodne hvide blodlegemer (Leukocytter). Disse fortrænger de sunde blodceller, dvs. modne leukocytter, røde blodlegemer (erytrocytter) og blodplader (thrombocytter). Dette medfører flere tegn på leukæmi. Det samme gør manglen på røde blodlegemer anæmi (Anæmi). Ofrene lider for eksempel under:
- bleghed
- hjertebanken
- åndenød
- svimmelhed
Manglen på blodplader ved akut leukæmi forårsager ofte en øget blødningstendens, For eksempel har patienter ofte blødninger i tandkød eller næse. Hvis det er såret, tager det længere tid end normalt for et sår at stoppe blødningen. Derudover bliver patienterne øget blå mærker (Hematoma) – et andet typisk tegn. I tilfælde af alvorlig mangel på blodplader (trombocytopeni) forekommer røde blødninger i huden kaldet petechiae.
Leukæmi kan også svække infektionsforsvaret. Som et resultat lider patienter ofte stædige infektioner som dårligt helende betændelse i mundhulen. Årsagen: Patientens krop har for lidt fungerende hvide blodlegemer – og disse bruges normalt til at afværge infektion. Immunsystemet i leukæmi er således generelt svækket.
Andre mulige symptomer på leukæmi er:
- smertefri hævede lymfeknuder
- forstørret lever og milt
- udslæt
- Gingival tilgroning
Kronisk leukæmi: symptomer
Kronisk leukæmi begynder lumsk. I de første måneder eller endda år har mange patienter ingen klager. Nogle rapporterer kun generelle symptomer, såsom træthed og nedsat ydeevne. Disse anerkendes normalt ikke som tegn på leukæmi. Derfor går de fleste patienter ikke til lægen. Det er kun på et avanceret stadium, at kronisk leukæmi udvikler symptomer, der ligner et akut forløb.
Ved Kronisk myelogen leukæmi (CML) Der er tre faser, hvor sygdommen bliver mere og mere aggressiv. Dette vises også ved leukæmistegn:
- Kronisk faseHer er antallet af hvide blodlegemer unormalt forhøjet (leukocytose), og milten forstørres (splenomegaly). Sidstnævnte kan forårsage en følelse af tryk i venstre øvre del af maven. Andre leukæmisymptomer på dette trin inkluderer træthed og nedsat ydeevne.
- Accelerationsfase (overgangsfase): Antallet af leukocytter fortsætter med at stige. Samtidig falder antallet af røde blodlegemer og blodplader. Typiske symptomer på CML er nu hudblænding, hjertebanken, åndenød og hyppig blødning af næse og tandkød. Nattsved og feber kan også forekomme. Leveren forstørres i stigende grad.
- Blast crisis (blast burst): I denne sidste fase af sygdommen frigiver knoglemarven store mængder umodne forløbere af blodceller (kaldet myeloblaster og promyelocytter) i blodet. Dette forårsager symptomer, der ligner symptomerne på akut leukæmi. De fleste patienter dør snart.
den Kronisk lymfocytisk leukæmi (CLL) skrider også langsomt frem. Derfor er udtrykket “leukæmi” i deres navn. Faktisk er dette ikke en blodkræft, men en speciel form for lymfom (ondartet lymfom).
Oversigt over leukæmiformer
De fire hovedformer for leukæmi er:
|
leukæmi Shape |
Bemærkninger |
|
Akut myeloid leukæmi (AML) |
– starter ganske pludselig og skrider hurtigt frem – mest almindelige akutte leukæmi – Cirka halvdelen af patienterne er ældre end 70 år |
|
Kronisk myeloid leukæmi (CML) |
– langsomt gradvist kursus (undtagen i sidste fase: eksplosionskrise) – gennemsnitsalder på begyndelse ved 50 til 60 år – meget sjældent hos børn |
|
Akut lymfocytisk leukæmi (ALLE) |
– starter ganske pludselig og skrider hurtigt frem – hyppigst af alle leukæmiformer – v.a. hos børn (ALLE er den mest almindelige kræftform hos børn); voksne patienter stort set ældre end 80 år |
|
Kronisk lymfocytisk leukæmi (CLL) |
– langsomt, gradvist kursus – mest almindelige leukæmi hos voksne; gennemsnitsalder på begyndelse ved 70 til 75 år – er ikke en af de “ægte” leukæmier, men til lymfeknude kræft (ondartet lymfom) |
Der er andre typer leukæmi, men de er meget sjældne. Et eksempel er hårcellecukæmi.
Relateret til leukæmi er de såkaldte myelodysplastiske syndromer (MDS), Dette er også kroniske sygdomme i knoglemarven, dannes i de utilstrækkeligt fungerende blodlegemer. Symptomerne ligner kronisk myelogen leukæmi. Men de er oprindeligt mindre udtalt. Hos cirka 25 til 30 procent af patienterne producerer myelodysplastisk syndrom før eller senere en fuldblæst leukæmi, nemlig akut myeloide leukæmi.
Myeloid leukæmi
Myeloide leukæmier er forårsaget af de såkaldte myeloide forløberceller i knoglemarven. Fra disse stamceller udvikler normalt sunde røde blodlegemer, blodplader og granulocytter og monocytter. De sidste to er undergrupper af hvide blodlegemer.
Når myeloide forstadierceller degenererer og begynder at vokse ukontrolleret, udvikler myeloid leukæmi. Afhængig af deres kursus, skelæger lægerne Akut myeloid leukæmi (AML) og Kronisk myeloid leukæmi (CML), Begge typer blodkræft er især almindelige hos voksne. AML er markant mere almindelig end CML.
Læs mere om de to former for myeloid blodkræft i artiklen Myeloid leukæmi.
Lymfatisk leukæmi
Lymfatiske leukæmier er baseret på andre blodcelleforløbere end myeloide blodkræft: de såkaldte lymfatiske stamceller degenererer her. Ud af dem mod lymfocytter. Denne undergruppe af hvide blodlegemer er meget vigtig for det specifikke (specifikke) forsvar mod fremmede stoffer og patogener (specifikt immunforsvar).
Igen taler man om afhængigt af sygdommen i Akut lymfatisk leukæmi (ALLE) eller Kronisk lymfocytisk leukæmi (CLM), ALLE er den mest almindelige form for blodkræft hos børn og unge. I modsætning hertil forekommer CLL typisk i voksen alder. Det omtales kun “leukæmi” (blodkræft) på grund af dens forløb. Faktisk er CLL en form for lymfeknudekræft – det er et af de såkaldte ikke-Hodgkins lymfom.
Mere om disse to kræftformer findes i artiklen Lymfatisk leukæmi.
Hårcelleleukæmi
Hårcellecukæmi (eller hårcellecukæmi) er en meget sjælden kræft. For dem gælder det samme som for den kroniske lymfocytiske leukæmi: Navnedelen “leukæmi” angiver kun, at sygdommen er som blodkræft. Imidlertid tilskrives det lymfeknudekræft (mere præcist: ikke-Hodgkins lymfom).
Navnedelen “hårceller” stammer fra det faktum, at kræftcellerne har behårede udvidelser.
Hårcellecukæmi forekommer kun i voksen alder. Mænd falder markant oftere end kvinder. Den kroniske sygdom er ikke særlig aggressiv. De fleste patienter har en normal forventet levealder.
Du kan læse alt om denne kræft i artiklen Hårcelle leukæmi.
Leukæmi hos børn
Frem for alt er leukæmi en sygdom hos voksne: de tegner sig for omkring 96 procent af alle patienter. Når der udvikles leukæmi hos børn, er det næsten altid akut lymfoblastisk leukæmi (ALLE). For det andet er akut myeloide leukæmi (AML). Kronisk leukæmi er meget sjælden hos børn.
Hvis akut blodkræft hos børn opdages og behandles tidligt, er chancerne for bedring gode. Til sammenligning er akut leukæmi hos voksne mere af en dårlig prognose.
Du kan finde ud af alt om blodkræft hos børn i artiklen om leukæmi hos børn.
Leukæmi: behandling
Leukæmibehandlingen tilpasses individuelt til hver patient. Forskellige faktorer spiller en rolle her. Ud over patientens alder og generelle sundhedstilstand er dette først og fremmest sygdomsforløbet (akut eller kronisk).
Akut leukæmi: behandling
Så snart som muligt efter diagnosen “akut leukæmi” patienter med a kemoterapi begynde. Det betragtes som den vigtigste terapi mod akut blodkræft. Patienten får specielle lægemidler, såkaldte cytostatika (kemoterapeutiske midler). De forhindrer kræftceller (og andre hurtigt delende celler) i at vokse. De beskadigede celler kan ikke formere sig yderligere. De genkendes derefter af kroppens egne kontrolmekanismer og målrettet demonteres.
De fleste er Cytostatika som infusion administreres direkte i en vene (som en infusion), men lejlighedsvis også som tabletter indtages. De kan gives individuelt eller i kombination såvel som i forskellige doser. Dette tillader, at kemoterapi tilpasses individuelt til hver patient. Behandlingen finder også sted i cykler: Patienten får cytostatika en dag eller flere dage i træk. Dette efterfølges af en behandlingspause (dage til måneder), før en ny cyklus startes. De fleste kræftpatienter får i gennemsnit fire til seks sådanne kemoterapicykler.
Grundlæggende finder akut leukæmibehandling sted i tre faser, der kan vare i måneder og år:
- induktion terapi: Patienter her får stærk kemoterapi, der sigter mod at eliminere så meget som muligt af alle kræftceller og lindre de mest alvorlige symptomer. Behandlingen udføres normalt på hospitalet.
- konsolidering terapi: Det er designet til at “størkne” succes med induktionsterapi. Mange patienter får tilpasset kemoterapi for at eliminere eventuelle resterende kræftceller.
- behandling vedligeholdelse: Målet her er at stabilisere behandlingssucces og forhindre tilbagefald (gentagelse). Vedligeholdelsesbehandlingen kan designes meget forskelligt fra patient til patient. Ofte gives cytostatika i tabletform i mindst et år.
Induktionsterapi kan være så vellykket, at næsten ingen kræftceller kan påvises i patientens blod og knoglemarv. Læger taler derefter om en remission. Det betyder ikke, at leukæmien helbredes. Det kan stadig have overlevet individuelle kræftceller. Derfor er yderligere terapitrin (konsolideringsterapi) nødvendig.
Efter vedligeholdelsesbehandling lukkes efterbehandling på: Blod og knoglemarv fra patienten undersøges regelmæssigt. Hvis det kommer til et tilbagefald, kan kræftcellerne påvises tidligt på denne måde. Derudover handler efterbehandling om behandling af eventuelle bivirkninger og langtidsvirkninger af tidligere kemoterapimetoder.
Yderligere terapimuligheder
Nogle gange er man detstamcelle også en del af leukæmibehandlingen. Stamcellerne er de “moderceller”, der udgør alle blodlegemer i knoglemarven (for livet). Før transplantation ødelægger kemoterapi i høj dosis (og mulig bestråling af hele kroppen) stort set hele patientens knoglemarv og (forhåbentlig) alle kræftceller. Derefter får patienten sunde stamceller som i en transfusion. Cellerne sætter sig i knoglenes medullære hulrum og producerer nye, sunde blodceller.
I de fleste leukæmi overføres stamceller fra en sund donor (Allogen stamcelletransplantation). Sjældent er det patientens egne stamceller, der blev taget fra ham før knoglemarvsødelæggelse (Autolog stamcelletransplantation). Behandlingsmetoden er især nyttig, når andre behandlinger (især kemoterapi) ikke er effektive, eller hvis patienten tilbageføres.
Mange patienter med akut lymfoblastisk leukæmi (ALL) får en ud over kemo strålebehandling, På den ene side bestråles hovedet som en forsigtighed, da kræftceller oftere angriber hjernen. På den anden side kan stråling bruges til specifikt at behandle malignt ændrede lymfeknuder (for eksempel i brystområdet).
Kronisk leukæmi: behandling
den Kronisk myeloid leukæmi (CML) opdages normalt i den kronisk stabile sygdomsfase (se ovenfor). Lægen ordinerer derefter for det meste såkaldte tyrosinkinaseinhibitor (som imatinib). Disse lægemidler er meget effektive mod blodkræftceller: de hæmmer vækstsignaler i cellerne. Dette kan stoppe sygdommen i mange år. Tyrosinkinaseinhibitorerne tages som en tablet, normalt for livet.
Samtidig kontrolleres patienterne blod og knoglemarv regelmæssigt. Hvis for eksempel blodniveauerne eller patientens tilstand forværres, indikerer dette, at CML bevæger sig ind i den næste fase (accelerationsfase). Lægen ændrer derefter medicinbehandlingen: han ordinerer andre tyrosinkinaseinhibitorer. Hos mange patienter kan sygdommen således spores tilbage til en kronisk stabil fase.
Hvis det ikke lykkes, kan man komme Allogen stamcelletransplantation i spørgsmålet – dvs. transplantation af sunde, bloddannende stamceller fra en donor. Indtil videre er dette den eneste form for terapi, der har potentialet til fuldstændigt at kurere kronisk myeloid leukæmi. Det er dog meget risikabelt. Derfor overvejes nøje og potentielle risici ved behandling nøje hos hver patient.
På et hvilket som helst stadie af sygdommen kan en patients tilstand forværres markant inden for en kort periode. Derefter taler læger om en eksplosionskrise. De berørte får en intensiv behandling, som i tilfælde af akut leukæmi kemoterapi, Så du prøver at undertrykke tegnene på sygdommen så hurtigt som muligt. Hvis patientens tilstand er forbedret og stabiliseret, kan en stamcelletransplantation være nyttig.
Nogle patienter med CML vil være sammen med interferoner behandles. Dette er messenger-stoffer, som cellerne i immunsystemet kommunikerer med hinanden med. De kan hæmme væksten af kræftceller. Imidlertid er interferoner – såvel som kemoterapi – normalt mindre effektive i CML end de ovenfor beskrevne tyrosinkinaseinhibitorer.
Dette er dog ikke altid tilfældet: tyrosinkinaseinhibitorer fungerer bedst hos patienter, hvis kræftceller har det såkaldte “Philadelphia-kromosom”. Dette kaldes et karakteristisk ændret kromosom 22. Det kan påvises i mere end 90 procent af alle CML-patienter. De resterende patienter har ikke det ændrede kromosom. I disse tilfælde fungerer behandling med tyrosinkinaseinhibitorer ofte ikke så godt. Derefter kan det være nødvendigt at ændre terapien og bruge for eksempel interferoner.
den Kronisk lymfocytisk leukæmi (CLL) kræver ikke behandling i lang tid hos mange patienter. Først når blodniveauerne forværres, eller når symptomerne udvikler sig i det avancerede trin, indleder medicin en terapi – tilpasset hver enkelt patient.
For eksempel modtager mange syge en kemoterapi plus såkaldt Monoklonale antistoffer (Immunokemoterapi eller kemoimmunoterapi): De kunstigt producerede antistoffer binder specifikt til kræftcellerne og markerer dem dermed for immunsystemet. Begge behandlinger bruges lejlighedsvis individuelt.
Hvis kræftcellerne har visse genetiske ændringer, skal behandling med TKI giver mening. Disse lægemidler blokerer for et patologisk ændret enzym, der fremmer væksten af kræftceller.
Når andre behandlinger ikke fungerer, eller hvis du senere falder tilbage, har læger undertiden en stamcelle af: CLL-patienterne overføres efter sunde kemoterapi, sunde, bloddannende stamceller fra en donor (allogen stamcelletransplantation). Denne risikable behandling er kun egnet til unge eller meget fit pasienter.
Ledsageforanstaltninger (understøttende terapi)
Ud over leukæmibehandling ved hjælp af kemoterapi, strålebehandling & Co. er understøttende foranstaltninger også meget vigtige. De tjener for eksempel til at reducere symptomer på sygdommen og konsekvenserne af behandlingen. Dette kan forbedre patienternes trivsel og livskvalitet i høj grad.
For eksempel Kvalme og opkast almindelige og meget ubehagelige bivirkninger ved kemoterapi mod leukæmi (og andre kræftformer). De kan lettes med specielle medicin (antiemetika).
den øget følsomhed over for infektioner er også et alvorligt problem med leukæmi. Både sygdommen og kemoterapi svækker immunsystemet. Det kan derefter bekæmpe patogener værre. Dette favoriserer infektioner, som også da kan være meget vanskelige. Nogle gange bliver de endda livstruende! Derfor er en omhyggelig hygiejne og en mulig miljø med lav kim meget vigtigt for leukæmipatienter. Mange modtager også antibiotikafor at forhindre eller behandle bakterielle infektioner. Også mod svampeinfektioner er der specielle midler, såkaldte svampemidler.
Også andre klager kan ofte behandles specifikt, for eksempel betyder anæmi (anæmi) blodtransfusion og smerter med passende smertestillende medicin.
Leukæmi: årsager og risikofaktorer
Årsagerne til de forskellige former for blodkræft er endnu ikke afklaret. Eksperter har imidlertid identificeret flere risikofaktorer, der fremmer udviklingen af leukæmi. Disse inkluderer:
Genetisk disponering: Risikoen for leukæmi er lidt forhøjet, hvis kræft oftere er forekommet i ens egen familie. Derudover gør visse genetiske sygdomme dem mere modtagelige for blodkræft. For eksempel er mennesker med trisomi 21 (Downs syndrom) 20 gange mere tilbøjelige til at have akut myeloide leukæmi (AML) end mennesker uden denne genetiske modifikation.
alder: Udviklingen af akut myelooid leukæmi (AML) påvirkes af alder: sygdomsrisikoen øges med årene i livet. Det samme gælder for kronisk myeloid leukæmi (CML) og kronisk lymfocytisk leukæmi (CLL). I modsætning hertil forekommer akut lymfoblastisk leukæmi (ALL) hovedsageligt i barndommen.
rygning: Røg udgør cirka ti procent af alle tilfælde af leukæmi, vurderer forskere. Hos aktive rygere er risikoen for akut myeloide leukæmi (AML) for eksempel 40 procent højere end hos mennesker, der aldrig har ryget. Hos tidligere rygere øges risikoen for sygdom stadig med 25 procent.
Ioniserende stråler: Ved dette forstår man forskellige energiske stråler, for eksempel radioaktive stråler. De beskadiger det genetiske materiale – især i de kropsceller, der ofte deler sig. Disse inkluderer de bloddannende celler i knoglemarven. Som et resultat kan leukæmi udvikle sig. Jo højere den strålingsdosis, der påføres kroppen, desto større er leukæmi-risikoen.
Strålebehandling til kræft bruger også sådan ioniserende stråling. Ikke kun kan de dræbe kræftcellerne som ønsket, men de kan også skade genomet i sunde celler. I sjældne tilfælde udvikler patienter en strålingsrelateret anden kræft.
Røntgenstråler ioniserer også. Eksperter antager imidlertid, at en lejlighedsvis røntgenundersøgelse ikke kan udløse leukæmi. Ikke desto mindre skal du kun fremstille røntgenbilleder, hvis det er absolut nødvendigt. Fordi skaden forårsaget af stråler i kroppen, kan tilføjes i løbet af livet.
Kemiske stoffer: Forskellige kemikalier kan øge risikoen for leukæmi. Disse inkluderer fx benzen og andre organiske opløsningsmidler. Også insekticider (insekticider) og pesticider (herbicider) formodes at fremme blodkræft.
Denne forbindelse er sikker på visse lægemidler, der faktisk bruges til at behandle kræft (såsom cytostatika): de kan fremme udviklingen af leukæmi på lang sigt. Før de bruges, vejer læger derfor nøje fordelene og risiciene ved sådanne lægemidler.
virus: Visse vira (HTL-vira I og II) er involveret i udviklingen af en meget sjælden type leukæmi. Mennesker i det japanske område er hovedsageligt påvirket af denne såkaldte human T-celle leukæmi. Hos os er denne blodkræftvariant ekstremt sjælden.
Alle andre former for leukæmi (AML, CML, ALL, CLL osv.) Opstår i henhold til den aktuelle videnstilstand uden involvering af vira eller andre patogener.
Leukæmi: undersøgelser og diagnose
Mens kronisk leukæmi normalt forbliver symptomfri i lang tid, begynder akutte former relativt pludselig og skrider hurtigt frem. Symptomer som nedsat ydeevne, bleghed, hurtig hjerteslag, hyppige næseblødninger eller vedvarende feber forekommer imidlertid også i mange andre og til tider ufarlige sygdomme. Derfor tages de ikke altid lige så alvorligt. Imidlertid formodes sådanne klager altid at være leukæmi. Derfor skal du bestemt gå til lægen.
Den første kontakt for mistænkt blodkræft er familielægen. Om nødvendigt henviser han patienten til en specialist, for eksempel til en specialist i blod og kræft (hæmatolog eller onkolog).
Samtale og fysisk undersøgelse
Lægen bliver den første sygehistorie at hæve (anamnesis). For at gøre dette spørger han, hvordan patienten generelt føler, hvad symptomerne er, og hvor længe de har varet. Det kan også være vigtigt at give oplysninger om andre sygdomme, der i øjeblikket eksisterer eller tidligere har opstået. Derudover spørger lægen for eksempel, om patienten får medicin, og om familiekræft er kendt.
Dette efterfølges af en grundig fysisk undersøgelse, Lægen vil blandt andet lytte til lungerne og hjertet, måle blodtrykket og scanne leveren, milten og lymfeknuder. Resultaterne hjælper lægen til bedre at vurdere patientens generelle tilstand.
blodprøve
Blodprøven er vigtig for mistænkt leukæmi eller en beslægtet sygdom. Det vil være en lille blodbillede og en Differential tæller blod oprettet. Det lille blodantal viser blandt andet antallet af hvide blodlegemer (samlet antal), de røde blodlegemer og blodpladerne. For det differentielle blodbillede måles de forskellige undergrupper af hvide blodlegemer individuelt. Derudover kan blodcellernes udseende vurderes under mikroskopet.
Patologisk ændrede blodtællinger, såsom en stigning i hvide blodlegemer og mangel på røde blodlegemer, kan være en vigtig indikator på leukæmi. De kan imidlertid også forårsage mange andre sygdomme.
Udover at blodcellerne også er i laboratoriet andre blodparametre såsom nyre- og leverværdier. Disse værdier angiver, hvor godt disse to organer fungerer. Hvis leukæmi bekræftes i det videre forløb, og nyren og / eller leverværdierne for patienten er dårlige, skal dette tages i betragtning i behandlingsplanlægningen.
Laboratoriet kontrollerer også, om der er tegn på infektion med bakterier, vira eller svampe i blodet. Disse bakterier kan også være ansvarlige for nogle lidelser, såsom forhøjede niveauer af hvide blodlegemer, feber og træthed.
knoglemarv
Enhver formodet leukæmi kræver omhyggelig undersøgelse af patientens knoglemarv. Til dette tager lægen en knoglemarvsprøve med lokalbedøvelse med en speciel nål, som regel fra bækkenbenet (knoglemarvsponering). Antal og udseende af knoglemarvsceller undersøges i laboratoriet. Typiske ændringer kan tydeligt påvise leukæmi. Nogle gange kan endda formen for sygdommen bestemmes. Derudover kan cellerne undersøges for ændringer i deres genom (for eksempel “Philadelphia-kromosomet” ved kronisk myeloide leukæmi).
Voksne og ældre børn får normalt lokalbedøvelse inden fjernelse af knoglemarv. For mindre børn kan en kort bedøvelse være nyttig. Hele punktering tager normalt kun ca. 15 minutter og kan udføres på ambulant basis.
Yderligere undersøgelser
Hvis diagnosen leukæmi bekræftes, er det ofte nødvendigt med yderligere undersøgelser. De skal vise, om andre kropsområder og organer er påvirket af kræftcellerne. Patientens generelle tilstand kan også bedømmes bedre ved sådanne undersøgelser. Dette er vigtigt i terapiplanlægningen.
Så du kan f.eks. Indre organer (milt, lever osv.) Ved hjælp af ultralyd undersøge. Til sidst vil det være en Computertomografi (CT) lavet. Denne billeddannelsesteknik er også nyttig til vurdering af knoglerne. Dette er vigtigt, hvis lægen har mistanke om, at kræftcellerne ikke kun har spredt sig i knoglemarven, men også i selve knoglen. Nogle gange bliver det en Magnetic Resonance Imaging (MRI) eller en scintigrafi udført.
Ved akut lymfoid leukæmi (ALL) såvel som nogle undertyper af akut myelooid leukæmi (AML) infiltrerer kræftceller undertiden hjernen eller hjernehinderne. Mulige tegn inkluderer hovedpine og nervesvigt såsom sløret syn og lammelse. Så kan man Prøve af cerebrospinalvæske taget (lumbale punktering) og analyseret på laboratoriet. En MR kan også være nyttig til at opdage et kræftanfald i hjernen.
Leukæmi: sygdomsforløb og prognose
Mange mennesker med leukæmi har i dag en meget bedre chance for at overleve end for mange år eller årtier siden. Moderne terapier kan ofte forbedre chancerne for bedring. Hvis kræften allerede er for fremskreden, kan behandling dog i det mindste lindre symptomerne hos mange patienter og forlænge deres overlevelse.
I individuelle tilfælde afhænger prognosen for leukæmi af forskellige faktorer. Først kræftformen og sygdomsstadiet på diagnosetidspunktet. En anden faktor, der påvirker prognosen, er, hvor godt patienten reagerer på terapien. Andre faktorer, der har indflydelse på forventet levealder og chancer for bedring i leukæmi, er patientens alder og generelle tilstand samt mulige komorbiditeter.
Leukæmi: helbredende chancer
“Er leukæmi helbredelig?” Mange patienter og deres familier stiller sig selv dette spørgsmål. I princippet gælder det for akut leukæmi Healing er mulig. Jo tidligere sygdommen opdages og behandles, jo større er chancerne for bedring. Dette gælder især for yngre patienter:
Uden behandling overlever de fleste patienter kun diagnosen akut leukæmi i cirka tre måneder. Under behandlingen lever 95 procent af børn og 70 procent af voksne stadig med akut lymfoblastisk leukæmi (ALLE) fem år efter diagnosen. Ved akut myelooid leukæmi (AML) er den 5-årige overlevelsesrate 40 til 50 procent hos patienter under 60 år og 20 procent i aldersgruppen 60+.
Selv hvis kræften kan skubbes tilbage, kan den senere komme til et tilbagefald (gentagelse), selv efter måneder og år. Især med et tidligt tilbagefald mindskes chancerne for bedring. Der skal derefter behandles leukæmipatienter igen. Manchmal wählen Ärzte dabei eine aggressivere Therapie oder andere Behandlungsmethoden.
Bei einerchronischen Leukämie vermehren sich die Krebszellen langsamer als bei akuten Krebsformen (Ausnahme: Blastenkrise bei CML) – und das meist jahrelang. Deshalb ist die Behandlung in der Regel weniger intensiv, muss dafür aber langfristig fortgesetzt werden. Heilen lässt sich eine chronische Leukämie im Allgemeinen zwar nicht (diese Chance besteht höchstens bei der riskanten Stammzelltransplantation). Bei vielen Patienten kann die Therapie aber die Symptome mildern und das Fortschreiten der chronischen Leukämie bremsen.
Weiterführende Informationen
Buchempfehlungen
Chronische Leukämien: Rat und Hilfe für Betroffene und Angehörige (Rat & Hilfe) (Hermann Delbrück, Kohlhammer, 2008)
Leitlinien
- S3-Leitlinie “Diagnostik, Therapie und Nachsorge für Patienten mit einer chronischen lymphatischen Leukämie” der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF), Deutschen Krebsgesellschaft e.V. und Deutschen Krebshilfe (2017)
- Leitlinie “Akute lymphoblastische Leukämie – ALL – im Kindesalter” der Gesellschaft für Pädiatrische Onkologie und Hämatologie (2016)
- Leitlinie “Chronische Myeloische Leukämie” der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen (2013)
- Leitlinie “Akute Myeloische Leukämie” der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen (2018)
Selbsthilfegruppen
MDS-NET Deutschland e.V. (www.mds-net-de.org)
Leukämie-Lymphom-Hilfe S.E.L.P. e.V. (www.selp.de)
Leukämie-Phoenix (www.leukaemie-phoenix.de)