Lungekræft (bronkial karcinom) er en af de mest almindelige kræftformer i Tyskland. Den vigtigste risikofaktor er rygning. Passiv rygning kan også føre til lungekræft. Den ondartede tumor kan behandles på forskellige måder, herunder kemo og kirurgi. Ikke desto mindre kan lungekræft sjældent hærdes. Læs alle vigtige oplysninger om lungekræft her!
Lungekræft: kort oversigt
- symptomer: i starten ofte ingen eller kun uspecifikke symptomer såsom vedvarende hoste, brystsmerter og træthed. Senere kan der tilføjes symptomer som åndenød, mild feber, alvorligt vægttab og blodig sputum.
- Hovedformer for lungekræft: Hyppigst er ikke-småcellet lungekræft (med adenocarcinom, pladecellecarcinom osv.). Mindre almindelig, men mere aggressiv er småcellet lungekræft.
- årsager: Især rygning. Andre risikofaktorer inkluderer asbest, arsenforbindelser, radon, et højt niveau af forurenende stoffer i luften og en lav-vitamin diæt.
- undersøgelser: Røntgen i brystet (røntgenbillede af brystet), computertomografi (CT), MR (magnetisk resonansafbildning, MRI), undersøgelse af vævsprøver (biopsier), positronemissionstomografi (normalt i kombination med CT som FDG-PET / CT), blodprøver, undersøgelse udkastet, undersøgelse af “lungevand” (pleural funktion)
- Terapi muligheder: Kirurgi, strålebehandling, kemoterapi.
- prognose: Lungekræft genkendes normalt sent og kan derfor sjældent hærdes.
Lungekræft: tegn
Lungekræft (lungecarcinom) forårsager i starten ofte ingen eller kun ikke-specifikke klager, Disse inkluderer træthed, hoste eller Brystsmerter, Men sådanne klager kan også have mange andre årsager, såsom forkølelse eller bronkitis. Derfor genkendes lungekræft ofte ikke i tidlige stadier. Det gør terapien vanskeligere.
Mere markante tegn forårsager lungekræft, når den allerede er avanceret. Så for eksempel Hurtigt vægttab, blodigt sputum og åndenød forekomme.
Har lungekræft allerede datterfamilier (metastaser) der dannes i andre dele af kroppen kommer mest andre symptomer tilføjet. F.eks. Kan metastaser i hjernen beskadige nerverne. Mulige konsekvenser inkluderer hovedpine, kvalme, syns- og balanceforstyrrelser eller endda lammelse. Hvis kræftcellerne har angrebet knoglerne, kan artroselignende smerte forekomme.
Læs mere om de forskellige tegn på lungekræft i artiklen Lungekræft: Symptomer.
Lungekræft: stadier
Som enhver kræft forekommer lungekræft, fordi celler degenererer. I dette tilfælde er de celler i lungevævet. De degenererede celler formerer sig ukontrolleret og fortrænger sundt væv i deres miljø. Senere kan individuelle kræftceller sprede sig gennem blodet og lymfekarrene i kroppen. Ofte danner de derefter en sekundær tumor (metastase) andre steder.
En lungekræftssygdom kan være så langt fremskreden. For eksempel taler man om et tidligt stadium eller i værste fald om lungekræftets slutfase. Men dette er ikke nøjagtigt definerede udtryk. Af denne grund bruger læger normalt den såkaldte TNM-klassificering: det tillader, at de enkelte lungecancer kræves præcist beskrevet. Dette er vigtigt, fordi behandlingen og forventet levealder af en patient afhænger af det respektive lungekræftstadium.
Lungekræft: TNM-klassificering og stadier
TNM-ordningen er et internationalt system til at beskrive spredningen af en tumor. Den siger:
- “T” for størrelsen på Tumors
- “N” for eventuel involvering af lymfeknuder (Nodi lymfatiske)
- “M” for den mulige tilstedeværelse af Metastasen
For hver af disse tre kategorier tildeler du en numerisk værdi. Det angiver, hvor fremskreden en patients kræft er.
Den nøjagtige TNM-klassificering for lungekræft er kompleks. Følgende tabel giver en grov oversigt:
|
TNM |
Tumorkarakter ved diagnose |
erklæring |
|
TX |
Okkult (skjult) karcinom |
Hverken røntgenbilleder eller computertomografi (CT) kan påvise en tumor, men patientens sputum har kræftceller. |
|
T1 |
Tumoren er mindre end 3 cm. Den største bronchus påvirkes ikke. |
De vigtigste bronchier er de første grene af luftrøret i lungerne. |
|
T2 |
Tumoren har en størrelse på 3 til 5 cm (T2a) eller 5 til 7 cm (T2b) |
og / eller mindst et af følgende kriterier er angivet:
|
|
T3 |
Tumoren er større end 7 cm |
eller givet mindst et af følgende kriterier:
|
|
T4 |
Tumorstørrelse spiller ikke længere en rolle her, men i stedet er denne fase til stede, når
|
|
|
n0 |
ingen lymfeknude involvering |
|
|
N1 |
Ipsilateral lymfeknudeinddragelse omkring bronchierne (peribronchial) eller på stedet for indtræden af lungekarrene og hovedbronkierne i lungerne (hilar) |
Udtrykket “ipsilateralt” betyder, at den berørte lymfeknude er i den samme lunge eller halvdelen af kroppen som den forårsagende lungetumor. “Kontrateralt” betyder, at lymfeknuder i den anden halvdel af kroppen / lungen påvirkes. |
|
N2 |
Ipsilateral lymfeknudeinddragelse under forgreningen af de vigtigste bronchier (subkarinal) eller brysthulen mellem de to lunger (mediastinal) |
|
|
N2 |
Ipsilateral lymfeknudeinddragelse over clavicle (supraklavikulær) eller hals eller angreb (i det mindste) af en kontralateral lymfeknude |
|
|
M0 |
Ingen fjerne metastaser |
|
|
M1a |
Metastaser i den kontralaterale lunge og / eller tung involvering af lungeforingen og / eller kræftceller i effusionsvæsken i lungeforingen er påviselige |
|
|
M1B |
fjernmetastaser |
Fjernmetastaser påvirker normalt leveren, hjernen, knoglerne og binyrerne |
TNM-klassificeringen bestemmer lungekræftstadiet: 4 trin adskilles. Jo højere fase, jo mere avanceret er sygdommen:
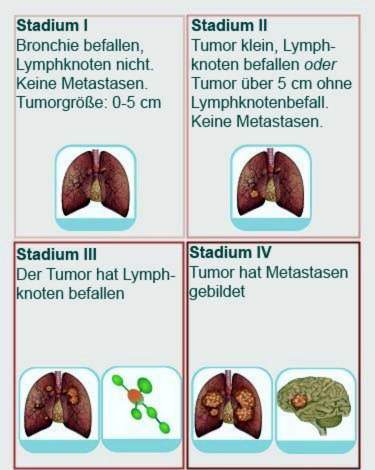
Lungekræftstadium I
Dette trin er opdelt i A og B. Fase IA svarer til en klassificering af T1 N0 M0. Det vil sige: Den ondartede lungetumor er mindre end tre inches. Den største bronchus påvirkes ikke af kræft. Derudover påvirkes ingen lymfeknuder, og der er endnu ikke dannet nogen fjerne metastaser.
På trin IB har tumoren en klassificering af T2a N0 M0: den er tre til fem centimeter i størrelse og begrænset til lungerne. Tumoren har derfor hverken påvirket lymfeknuder eller spredt sig i andre organer eller væv.
I denne første fase har lungekræft den bedste prognose og kan ofte hærdes.
Lungekræftstadium II
Også her er A og B. differentieret. Fase IIA inkluderer lungetumorer i T2b-kategorien, som endnu ikke har påvirket lymfeknuder (N0) eller har dannet metastaser (M0). Også tumorer i kategorien T1 N1 M0 hører hjemme.
Fase IIB inkluderer tumorer i klassificeringen T3 N0 M0 eller T2b N1 M0.
Selv i fase II er lungekræft stadig hærdelig i nogle tilfælde. Forventet levetid for patienter er allerede lavere end i fase I.
Lungekræft fase III
Fase IIIA er, når lungekræft klassificeres som T1 / T2 N2 M0 eller T3 N1 / 2 M0 eller T4 N0 M0. Fase IIIB beskriver enhver lungekræft med N3 M0 eller T4 N2 M0.
I lungekræftstadium III er tumoren skredet så langt, at patienter kun kan helbredes i sjældne tilfælde.
Lungekræftstadium IV
Levealder og chancer for bedring er meget lave på dette tidspunkt. Patienten kan kun modtage palliativ terapi: den sigter mod at lindre symptomerne og forlænge overlevelsen. Fase IV inkluderer al lungekræft, der allerede har dannet fjerne metastaser (M1). Tumorstørrelse og lymfeknudeinddragelse spiller ikke længere en rolle – de kan variere.
Småcelle bronkialkarcinom: alternativ klassificering
Læger adskiller to hovedgrupper af lungekræft: småcellet lungecarcinom og ikke-småcellet lungekræft (se nedenfor). Begge kan klassificeres i henhold til ovennævnte TNM-klassificering på stadioner.
Ved lille celle bronkial karcinom kan en alternativ klassificering alternativt anvendes:
- meget begrænset sygdom: maksimalt op til T2 og N1
- begrænset sygdom: T3 / 4 med N0 / 1 eller T1 til T4 med N2 / N3
- omfattende sygdom: M1 uafhængig af T og N
Lungekræft: behandling
Terapien med en bronkial karcinom er meget kompliceret. Det er individuelt tilpasset hver patient: Først og fremmest afhænger det af lungekræftens type og spredning. Patientens alder og generelle helbred spiller imidlertid også en vigtig rolle i terapiplanlægningen.
Hvis behandlingen sigter mod at helbrede lungekræft, kaldes den en helbredende terapi, Patienter, der ikke længere er i stand til at heles, modtager en palliativ terapi, Det er beregnet til at maksimere patientens levetid og lindre hans symptomer.
Læger fra forskellige hospitaler rådgiver hinanden om den endelige behandlingsstrategi. Disse inkluderer fx radiologer, kirurger, internister, strålingslæger og patologer. I regelmæssige sessioner (“tumortavler”) forsøger de at finde den bedste lungekræftterapi for en patient.
Der er tre forskellige terapeutiske tilgange, der anvendes individuelt eller i kombination:
- en operation til at fjerne tumoren
- kemoterapi med specielle lægemidler mod kræftceller
- strålingen af tumoren
Lungekræft: kirurgi
En reel chance for bedring i lungekræft som regel kun så længe du kan operere med den. Kirurgen forsøger at fjerne det kræftformede lungevæv fuldstændigt. Han skærer også en kant af sundt væv ud. Så han vil sikre sig, at der ikke efterlades kræftceller. Afhængig af spredningen af bronkialkarcinom, kan du enten fjerne det en eller to lungelobber (Lobektomi, bilobektomi) eller endda en hel lunge (Pneumonectomy).
I nogle tilfælde ville det være fornuftigt at tage en hel lunge ud. Patientens dårlige helbred tillader ikke dette. Derefter fjerner kirurgen så meget som nødvendigt, men så lidt som muligt.
Under operationen omgivende lymfeknuder udskåret (mediastinal lymfeknude dissektion). Dette gøres, selvom de foreløbige undersøgelser ikke har givet nogen indikation af kræftindflydelse i lymfeknuderne. Ofte er dette den første station, der flytter, som ikke kan genkendes i starten.
Desværre er der ofte ingen chance for, at en operation kan helbrede lungekræft: tumoren er allerede for fremskreden. Hos andre patienter er tumoren principielt operationel. Patientens lungefunktion er imidlertid så dårlig, at han ikke ville være i stand til at klare dele af lungerne. I starten skal lægerne derfor med særlige undersøgelser kontrollere, om en operation på en patient giver mening.
Lungekræft: kemo
Som mange andre kræftformer kan lungekræft også behandles med kemoterapi. Patienten modtager medicin, der hæmmer celledeling og dermed tumorvækst. Disse midler kaldes kemoterapeutiske midler eller cytostatika.
Kemoterapi alene er ikke nok til at kurere lungekræft. De bruges derfor normalt i kombination med andre behandlinger. For eksempel kan det gøres inden operation for at skrumpe tumoren (Neoadjuvant kemoterapi). Derefter skal kirurgen skære mindre væv ud.
I andre tilfælde antages postoperativ kemoterapi at ødelægge kræftceller, der stadig er i kroppen (adjuvant kemoterapi).
Kemoterapi mod lungekræft findes normalt flere behandlingscyklusser, Så der er visse dage, hvor lægen administrerer medicinen. Mellem disse tages to til tre ugers behandlingspauser. Oftest modtager patienten lægemidlerne som en infusion via en vene. Nogle gange gives præparaterne imidlertid også i tabletform (oralt).
For at kontrollere effekten af kemoterapi undersøges patienten regelmæssigt ved hjælp af computertomografi (CT). Så lægen genkender, om han skal justere kemoterapien. Han kan for eksempel øge lægemiddeldosen eller ordinere et andet cytostatisk medikament.
Lungekræft: stråling
En anden tilgang til lungekræftbehandling er stråling. Lungekræftpatienter modtager normalt strålebehandling ud over en anden form for behandling. Som kemoterapi kan stråling f.eks. Være før eller efter operationen gjort. Ofte bruges de også ud over kemoterapi. Det er hvad du kalder det kemo- og stråleterapi.
Nogle lungekræftpatienter får også en såkaldt Profylaktisk kraniel bestråling, Med andre ord bestråles kraniet som en forholdsregel for at forhindre dannelse af hjernemetastaser.
Hvis lungekræft stadig er på et meget tidligt stadium, er bestråling undertiden tilstrækkelig som den eneste terapi til at helbrede patienten.
Andre behandlinger af lungekræft
De nævnte behandlingsformer er direkte rettet mod den primære tumor og mulige lungekræftmetastaser. I løbet af sygdommen kan der dog forekomme forskellige klager og komplikationer, som også skal behandles:
- Når der er en effusion mellem lungerne og lungenpleuraeksudat), det suger ham ud (Pleurapunktion). Hvis effusionen fortsætter igen, kan du indsætte et lille rør mellem lungen og pleuraen, som væsken flyder over. Han bliver længere i kroppen (dræning af brystet).
- Tumoren kan Blødning i bronchier forårsage. Disse kan for eksempel stoppes ved selektiv lukning af det pågældende blodkar, for eksempel som en del af en bronkoskopi.
- Den voksende tumor kan Luk blodkar eller luftveje, For at komme igennem igen, kan du indsætte en stent, så et stabiliserende rør. I andre tilfælde fjernes tumorvævet på det relevante sted, for eksempel med en laser.
- Avanceret lungekræft kan forårsage alvorlig smerte (cancersmerterårsag). Patienten modtager derefter en passende smerteterapi, for eksempel smertestillende som en tablet eller sprøjte. Ved smertefulde knoglemetastaser kan stråling give lettelse.
- åndedrætsbesvær kan lettes med medicin og ilt. Nyttige er også specielle vejrtrækningsteknikker og korrekt opbevaring af patienten.
- ved stort vægttab har du muligvis brug for at fodre patienten kunstigt.
- Bivirkninger af kemoterapi såsom kvalme og anæmi kan behandles med passende medicin.
Ud over behandlingen af fysiske lidelser er det også meget vigtigt, at patienten mentalt godt set er. Psykologer, sociale tjenester og selvhjælpsgrupper hjælper med sygdomshåndtering. Dette øger livskvaliteten for patienten. De pårørende kan og bør inkluderes i terapikoncepterne.
Lille celle bronkial karcinom
Behandlingen af lungekræft påvirkes af, hvilken type tumor det er. Afhængigt af hvilke celler i lungevævet til kræftceller, adskiller læger to hovedgrupper af lungekræft: En af dem er småcellet lungecancer (SCLC = lillecellet lungekræft).
Denne type lungekræft vokser meget hurtigt og danner tidlige metastaser (metastaser) i andre dele af kroppen. Derfor er kemoterapi den vigtigste terapi her. Mange patienter får også strålebehandling. Dette skulle forbedre chancerne for succes med behandlingen.
Kirurgi giver normalt kun mening, hvis svulsten stadig er meget lille, og ingen eller kun et par få nærliggende lymfeknuder påvirkes. Dette gælder dog kun individuelle patienter: på diagnosetidspunktet er småcellet lungecancer normalt mere avanceret.
Læs mere om udviklingen, behandlingen og prognosen for denne form for lungekræft i artiklen SCLC: Small Cell Lung Cancer.
Ikke-lillecellet lungecarcinom
Ikke-småcellet lungekræft er den mest almindelige form for lungekræft. Det er ofte forkortet til NSCLC (“ikke-småcellet lungekræft”). Strengt taget omfatter udtrykket “ikke-lille celle bronkial karcinom” forskellige typer af tumorer. Disse indbefatter for eksempel adenocarcinom og pladecellecarcinom.
For alle ikke-småcellet lungecarcinomer vokser de langsommere end småcellet lungecancer og senere formmetastaser. De reagerer ikke så godt på kemoterapi.
Den valgte behandling er derfor, hvis det er muligt, en operation: kirurgen forsøger at fjerne tumoren fuldstændigt. Hvis dette ikke er muligt, modtager patienten yderligere stråling. Før eller efter operationen kan kemoterapi gives som støtte. Hvis ikke-småcellet lungecarcinom påvises på et meget tidligt tidspunkt, kan endda en enkelt eksponering være tilstrækkelig.
I nogen tid har der været andre terapeutiske fremgangsmåder, såsom behandling med antistoffer. De er kun egnede til visse patienter.
Læs mere om denne udbredte form for lungekræft i artiklen NSCLC: Ikke-småcellet lungekræft.
Lungekræft: årsager og risikofaktorer
Årsagen til lungekræft er en ukontrolleret vækst af celler i det såkaldte bronchiale system. Dette henviser til de store og små luftveje i lungerne (bronchier og bronchioler). Det medicinske navn for lungekræft er derfor bronkialkarcinom. Ordet del “karcinom” står for en ondartet tumor fra såkaldte epitelceller. De danner dækstoffet, der linjer luftvejene.
De ukontrollerede voksende celler formerer sig meget hurtigt. Debei fortrænger i stigende grad sundt lungevæv. Derudover kan kræftcellerne sprede sig gennem blod og lymfekar og danne en dattergulv et andet sted. Sådanne fjernelser kaldes lungekræftmetastaser.
Lungekræftmetastaser bør ikke forveksles med lungemetastaser: Dette er sekundære tumorer i lungerne, der udspringer af kræftsvulster andre steder i kroppen. For eksempel forårsager tyktarmskræft og nyrecellekarcinom ofte lungemetastaser.
Rygning: Den vigtigste risikofaktor
Den vigtigste risikofaktor for ukontrolleret og ondartet cellevækst i lungerne er rygning, Cirka 90 procent af alle mænd med lungekræft har aktivt ryget eller gør det stadig. For kvinder gælder dette for mindst 60 procent af patienterne. Jo højere risikoen for sygdom, jo tidligere begyndte nogen at ryge, og jo mere ryger man.
Læger måler det tidligere cigaretforbrug af en patient i enheden “pack år“(Pakkeår). Hvis nogen ryger en pakke cigaretter om dagen i et år, regnes dette som “en pakkeår”. Hvis han ryger en kasse om dagen i ti år eller to kasser om dagen i fem år, er det 10 pakke år hver. Jo flere års emballering, jo større er risikoen for lungekræft.
Ud over antallet af røgede cigaretter Slags rygning en rolle: jo mere røg du indånder, jo værre er det for lungerne. Lungekræftrisikoen har også en indvirkning cigaretter steder: Stærke eller endda filterløse cigaretter er særlig skadelige.
I nogle år ved man det også Teenagere og kvinder mere følsomme over for kræftfremkaldende stoffer i tobaksrøg end voksne og mænd.
Imidlertid er det ikke alle, der røg i nogle år i deres fortid, at være bange for lungekræft. Heldigvis kan lungerne også komme sig. Bare få år efter rygestop er risikoen for lungekræft faldet markant. Cirka 20 til 30 år efter den sidste cigaret har en eks-ryger næsten den samme sygdomsrisiko som nogen, der aldrig har slukket. Så det er aldrig for sent at holde op med at ryge.
Passiv rygning øger også risikoen for lungekræft!
Andre risikofaktorer for lungekræft
Bortset fra rygning er der andre faktorer, der kan øge risikoen for lungekræft:
- Materialer som Asbest, arsenforbindelser eller kvarts- og nikkelstøv
- Høj luftforurening: Den vigtigste faktor er diesel sod. Partikler synes også at have en negativ indflydelse på lungekræftrisikoen.
- radon: Naturlig, radioaktiv gas koncentreres i visse områder. Det findes hovedsageligt i bygningernes nederste etager.
- Gene: I en vis grad synes lungekræft at være arvelig. Især hos meget unge patienter mistænker eksperter en genetisk disponering. Dette kan gøre befolkningen mere modtagelig for lungeskadelige påvirkninger (såsom rygning).
- Lung ardannelse: De opstår for eksempel som et resultat af tuberkulose eller efter operationen.
- virus: Virussygdomme kan også være involveret i udviklingen af bronchiale kræft. Der er mistanke om HIV og humant papillomavirus (HPV).
- Diæt med lavt vitaminindhold: Hvis du spiser lidt frugt og grøntsager, ser det ud til, at risikoen for lungekræft øges. Dette gælder især for rygere. Indtagelse af vitamintilskud er imidlertid ikke et alternativ: Især hos rygere ser sådanne præparater ud til at øge risikoen for bronkialkræft yderligere.
Hvis flere af disse faktorer er til stede på samme tid, sænkes sandsynligheden for lungekræft ikke bare op: snarere øges risikoen for sygdom mange gange. For eksempel øger en høj forurenende belastning i luften lungekræftrisikoen hos rygere meget mere end hos ikke-rygere.
Nogle gange kan du ingen årsag til lungekræft finde. Dette kaldes en idiopatisk sygdom. Af alle typer lungekræft gælder dette oftest for det såkaldte adenocarcinom. Dette er en form for ikke-småcellet lungecarcinom.
Lungekræft: undersøgelser og diagnose
Lungekræftdiagnosen stilles ofte sent. Symptomer som vedvarende hoste, brystsmerter og åndenød anerkendes ofte ikke af rygere som mulige tegn på lungekræft. De fleste patienter skylder simpelthen rygning. Andre mistænker en alvorlig forkølelse, bronkitis eller lungebetændelse bag ubehaget. Kun medicinske undersøgelser giver derefter mistanke om et bronkialkarcinom.
Det første kontaktpunkt for mulige symptomer på lungekræft er familielægen. Om nødvendigt henviser han patienten til specialister, for eksempel til en røntgenlæge (radiolog), pulmonolog (pulmonolog) eller kræftspecialist (onkolog). For at diagnosticere lungekræft er det nødvendigt med en undersøgelse af den medicinske historie, en fysisk undersøgelse og forskellige apparater.
Medicinsk historie og fysisk undersøgelse
Først sammenlægger lægen patientens medicinske historie (anamnese) i samtale med patienten:
Han beskriver symptomerne som åndedrætsbesvær eller smerter i brystet nøjagtigt. Han spørger også om risikofaktorer for lungekræft, for eksempel spørger han, om patienten ryger eller arbejder på materialer som asbest eller arsenforbindelser.
Oplysninger om mulige allerede eksisterende eller underliggende sygdomme, såsom KOL eller kronisk bronkitis, er også vigtig for diagnosen lungekræft. Patienter skal også fortælle lægen, hvis der allerede var tilfælde af lungekræft i deres familie.
Efter anamneseintervjuet undersøger lægen omhyggeligt patienten fysisk. For eksempel tapper han og hører patientens lunger og måler blodtrykket og pulsen. Undersøgelsen kan give antydninger til årsagen til klagerne. Derudover kan lægen således bedre vurdere patientens generelle helbred.
Røntgen
Ved hjælp af et røntgenbillede af brystet (røntgenbillede af brystet) kan lægen allerede registrere visse ændringer i lungevævet. Hvis dette fører til mistanke om lungekræft, er det næste trin computertomografi (CT).
I øvrigt undersøger lægen patienten i to niveauer, dvs. forfra og fra siden.
Computertomografi (CT)
Computertomografi giver detaljerede snitbilleder af lungerne i høj opløsning. Dette er muligt ved hjælp af røntgenstråler, som er signifikant højere dosis end med en normal røntgenstråle. Derudover får patienten et kontrastmiddel på forhånd. Så de forskellige vævsstrukturer er bedre repræsenteret.
Lægen kan bruge CT til at vurdere mistænkelige lungeforandringer bedre end røntgenbillederne. Dette kan bekræfte mistanken om lungekræft.
Undersøgelse af vævsprøver (biopsi)
For at være sikker på, at et prominent sted i lungevævet faktisk er et bronkialkarcinom, skal man tage et lille stykke væv og undersøge det mikroskopisk. Afhængig af placeringen af det mistænkelige område bruges forskellige metoder:
I lungereflektionen (bronkoskopi) introducerer et rør med et lille kamera (endoskop) over munden eller næsen i patientens luftrør og videre ind i bronkierne. Når man ser indeni, kan en tumor ofte allerede genkendes visuelt. Derudover kan lægen i forbindelse med bronchoskopi med fine instrumenter under visuel kontrol vævsprøver og sekretioner fra lungerne.
Hvis du ikke kan nå det mistænkelige væv gennem bronkierne dårligt eller slet ikke, udfører lægen en såkaldt transthoracic nål aspiration Gennem: Han stikker med en meget fin nål udefra mellem ribbenene. Under CT-kontrol fører han nålespidsen til det mistænkte lungeområde. Derefter suger han (aspirerer) noget væv over nålen.
Hos nogle patienter er hverken bronkoskopi eller transthoracisk nålaspiration mulig. I andre tilfælde giver begge studier intet klart resultat. Så kan man kirurgisk biopsi nødvendigt: enten åbner kirurgen brystkassen med et større snit (thoracotomi) og tager en prøve af det mistænkelige væv. Eller han lægger små udskæringer i brystet, som han introducerer et lille kamera og fine instrumenter til fjernelse af væv (videoassisteret thorakoskopi, VATS).
Den fjernede vævsprøve undersøges under mikroskopet. Som regel er det allerede muligt ved hjælp af færre celler at påvise, om lungekræft er til stede, og i bekræftende fald hvilken type tumor (cytologisk diagnose). Kun i særlige tilfælde er det nødvendigt at undersøge større vævsafsnit (histologisk diagnose).
Undersøgelse af tumorspredning (iscenesættelse)
Hvis diagnosen “lungekræft” er klar, er det næste trin at undersøge dens spredning i kroppen. Denne del af undersøgelsen omtales af læger som iscenesættelse (engelsk for “iscenesættelse”). Kun ved en sådan iscenesættelse kan de klassificere bronkialkarcinom i henhold til TNM-klassificeringen.
Iscenesættelse involverer tre trin:
- Undersøgelse af tumorstørrelse (T-status)
- Undersøgelse af lymfeknudeinddragelse (N-status)
- Søg efter metastaser (M-status)
Undersøgelse af den primære tumor (T-status)
Først og fremmest undersøger vi størrelsen på den tumor, hvorfra lungekræft stammer (primær tumor). Til dette formål modtager patienten et kontrastmiddel, før han bruger sit bryst og øvre mave computertomografi (CT) undersøgt. Kontrastmediet akkumuleres i kort tid hovedsageligt i tumorvævet og forårsager et mærke på CT-billedet. Så lægen kan vurdere omfanget af den primære tumor.
Hvis undersøgelsen med CT ikke er meningsfuld nok, anvendes yderligere procedurer. Dette kan f.ekse Ultralydundersøgelse i brystet (thorax-sonografi) eller en MR Vær (MRT).
Undersøgelse af lymfeknudeinddragelse (N-status)
For at planlægge behandlingen optimalt, skal lægen vide, om lungekræft allerede har påvirket lymfeknuder. Igen hjælper undersøgelsen ved hjælp af computertomografi (CT). Ofte bruges en særlig teknik: den såkaldte FDG-PET / CT, Dette er en kombination af positronemissionstomografi (PET) og CT:
Positronemissionstomografi (PET) er en nuklearmedicinsk undersøgelse. Den liggende patient injiceres først med en lille mængde af et radioaktivt stof i en blodåre. FDG-PET / CT handler om FDG, Dette er en radiomærket enkel sukker (fluorodeoxyglucose). Det spreder sig i kroppen og akkumuleres især i væv med øget metabolisk aktivitet, for eksempel i kræftvæv. I løbet af denne periode skal patienten forblive så stille som muligt. Efter ca. 45 (til 90) minutter udføres PET / CT-scanningen for at visualisere fordelingen af FDG i kroppen:
PET-kameraet kan meget godt repræsentere den forskellige metaboliske aktivitet i de forskellige væv. Særligt aktive områder (såsom kræftceller i lymfeknuder eller metastaser) “lyser” bogstaveligt talt på PET-billedet. Knogler, organer og andre strukturer i kroppen kan ikke repræsentere PET så godt. Dette gøres ved den næsten samtidige computertomografi CT (PET-kamera og CT er kombineret i en enhed). Det giver en meget nøjagtig repræsentation af de forskellige anatomiske strukturer. Kombineret med den nøjagtige kortlægning af metabolisk aktivitet er det muligt at lokalisere kræftlæsioner nøjagtigt.
Konklusion: Ved hjælp af FDG-PET / CT kan metastaser af lungekræft i lymfeknuder og endnu fjernere organer og væv vises meget nøjagtigt. For at være på den sikre side kan lægen tage en vævsprøve af det mistænkelige område og undersøge det for kræftceller (biopsi).
Søg efter metastaser (M-status)
Spredning af kræftceller i andre organer er et stort problem ved bronkialkarcinom. Metastasen bilden sich besonders oft in Leber und Gehirn sowie in den Knochen und Nebennieren. Prinzipiell kann aber jede Körperstruktur von den Krebszellen befallen werden. Lungenkrebs, der bereits gestreut hat, gilt als nicht mehr heilbar.
Mit der oben beschriebenen Spezialuntersuchung FDG-PET/CT können Metastasen überall im Körper nachgewiesen werden. Um mögliche Absiedlungen im Gehirn ausfindig zu machen, wird zudem der Schädel mittels MR (MRI) undersøgt.
Bei manchen Patienten ist eine FDG-PET/CT nicht möglich. Die Alternative ist dann eine computertomografi eller Ultralyd des Rumpfes und zusätzlich eine sogenannte Knochenszintigrafie, også Ganzkörper-MRT-Aufnahmen sind möglich.
blodprøver
Es gibt keine Blutwerte, mit deren Hilfe sich Lungenkrebs sicher diagnostizieren lässt. Allerdings kann man sogenannte Tumormarker im Blut bestemme. Das sind Substanzen, deren Blutspiegel bei einer Kresberkrankung erhöht sein kann. Denn die Tumormarker werden entweder von den Krebszellen selbst oder aber vom Körper als Reaktion auf den Krebs verstärkt produziert.
Mediziner kennen zwei Tumormarker, die bei Lungenkrebs oft erhöht sind: die neuronenspezifische Enolase (NSE) und CYFRA 21-1. Anhand dieser Marker allein kann man aber keine Diagnose stellen. Sie dienen vielmehr der Verlaufsbeurteilung: Ihre Konzentration im Blut wird regelmäßig bestimmt. So kann der Arzt abschätzen, wie schnell der Tumor wächst beziehungsweise ob nach einer Behandlung erneut Krebszellen auftauchen.
Untersuchung des Auswurfs
Der Auswurf (Sputum), den ein Patient aus der Lunge hochhustet, kann ebenfalls untersucht werden. Diese Methode wird vor allem dann angewendet, wenn andere Diagnoseverfahren nicht möglich sind (etwa weil der Gesundheitszustand des Patienten zu schlecht ist).
Ist der Auswurf unauffällig, heißt das aber nicht unbedingt, dass kein Lungenkrebs vorliegt. Die Untersuchung des Auswurfs dient eher dazu, einen bereits vorhandenen Verdacht zu bestätigen.
Untersuchung von Lungenwasser
Bei Lungenkrebs-Patienten bildet sich oft “Lungenwasser”. Das heißt: Es sammelt sich vermehrt Flüssigkeit zwischen Lungenfell und Rippenfell. Ein solcher Pleuraerguss kann aber auch andere Ursachen haben. Zur Abklärung wird der Arzt über eine feine Hohlnadel eine Probe des Ergusses entnehmen (Pleurapunktion) und mikroskopisch untersuchen. So kann er feststellen, wodurch der Erguss entstanden ist.
Gibt es Vorsorgeuntersuchungen bei Lungenkrebs?
Eine allgemeine Früherkennung, wie man sie zum Beispiel bei Brustkrebs, Darmkrebs oder Hautkrebs anwendet, ist bei Lungenkrebs schwierig. Man könnte zwar regelmäßig zum Beispiel Röntgen-Aufnahmen des Brustkorbs machen, das Blut auf Tumormarker untersuchen oder den Auswurf analysieren. Solche Vorsorgeuntersuchungen sind aber entweder zu ungenau oder aber zu empfindlich. Im zweiten Fall könnte sich ein unbegründeter Krebsverdacht ergeben. Außerdem bedeuten regelmäßige Röntgen- oder auch CT-Untersuchungen eine Strahlenbelastung für den Betroffenen.
Menschen, die ein hohes Risiko für Lungenkrebs haben, könnten allerdings von Vorsorgeuntersuchungen profitieren. Es wurden zum Beispiel Studien durchgeführt, bei denen Risikopatienten regelmäßig mittels Computertomografie (CT) mit niedriger Strahlendosis untersucht wurden. Auf diese Weise konnte etwa bei starken Rauchern Bronchialkrebs früher entdeckt werden. Dies muss aber noch genauer untersucht werden. Erst dann kann man vielleicht solche Vorsorgeuntersuchungen für bestimmte Risikogruppen empfehlen.
Lungenkrebs: Krankheitsverlauf und Prognose
Für Patienten, die eine Therapie mit Heilungsabsicht (kurative Therapie) bekommen haben, gibt es einen speziellen Nachsorgeplan. Nach Abschluss der Behandlung sollten sie in regelmäßigen Abständen zu Kontrolluntersuchungen ins Krankenhaus gehen. Besonders wichtig sind regelmäßige Röntgen- und CT-Bilder. Der Arzt wird diese jeweils im Vergleich zu den letzten Aufnahmen des Patienten beurteilen.
Auch Patienten, bei denen keine Heilung mehr zu erwarten ist, werden regelmäßig vom Arzt untersucht. So lässt sich feststellen, ob die palliative Therapie die Symptome ausreichend lindert oder eventuell angepasst werden muss.
Lungenkrebs: Prognose
Insgesamt hat das Bronchialkarzinom eine schlechte Prognose: Lungenkrebs wird bei vielen Patienten erst entdeckt, wenn die Erkrankung bereits weit fortgeschritten ist. Eine Heilung ist dann oft nicht mehr möglich. Wird der Lungenkrebs in frühen Stadien entdeckt, kann man eventuell operieren. Nach einiger Zeit bildet sich aber oft ein erneuter Krebstumor (Rückfall = Rezidiv).
Gerade weil die Heilungschancen so gering sind, ist es wichtig, das Risiko für Lungenkrebs nicht unnötig zu erhöhen. Der wichtigste Faktor, den jeder selbst in der Hand hat, ist das Rauchen. Wer auf das Qualmen verzichtet oder gar nicht erst damit anfängt, senkt deutlich sein persönliches Risiko für ein Bronchialkarzinom. Prognose und Verlauf einer bereits bestehenden Lungenkrebs-Erkrankung lassen sich ebenfalls verbessern, wenn man mit dem Rauchen aufhört.
Lungenkrebs: Lebenserwartung
Wer die Diagnose Lungenkrebs bekommt, stellt sich oft die Frage: “Wie lange werde ich noch leben?” Für den Arzt ist es nicht ganz einfach, diese Frage zu beantworten. Die Lebenserwartung bei Lungenkrebs hängt nämlich von verschiedenen Faktoren ab:
Es spielt zum Beispiel eine Rolle, wie weit fortgeschritten der Tumor zum Zeitpunkt der Diagnose ist. Lungenkrebs wird oft erst spät entdeckt, was sich nachteilig auf die Lebenserwartung des Patienten auswirkt. Ebenfalls einen Einfluss auf das Überleben hat die Art des Tumors: Nicht-Kleinzellige Bronchialkarzinome wachsen langsamer als Kleinzellige. Sie haben deshalb generell eine bessere Prognose.
Der allgemeine Gesundheitszustand ist ebenfalls wichtig: Wenn zum Beispiel die Herz- und Lungenfunktion eines Patienten deutlich geschwächt sind, kann es sein, dass bestimmte Behandlungsformen nur eingeschränkt oder gar nicht durchgeführt werden können. Das kann die Lebenserwartung des Lungenkrebs-Patienten deutlich senken.
Nähere Informationen zu Lebenserwartung und Heilungschancen bei Lungenkrebs erfahren Sie im Text Lungenkrebs: Lebenserwartung.
Yderligere information:
retningslinjer:
- S3-Leitlinie “Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms” der Arbeitsgemeinschaft der Wissenschaftlichen MedizinischenFachgesellschaften e.V., der Deutschen Krebsgesellschaft e.V. und der Deutschen Krebshilfe (2018)
Support Grupper:
- Bundesverband Selbsthilfe Lungenkrebs e.V.
- Selbsthilfe Lungenkrebs
- Deutsche Krebshilfe e.V.